Tag: FDA
Litige de brevet et entrée des génériques : comment fonctionne la certification Paragraph IV
La certification Paragraph IV permet aux génériques de contester les brevets des médicaments de marque avant leur lancement. Ce mécanisme, créé en 1984, a révolutionné l'accès aux médicaments abordables aux États-Unis, mais il est devenu un champ de bataille juridique coûteux.
Voir plusANDA Process: Les exigences légales pour l'approbation des médicaments génériques aux États-Unis
Le processus ANDA permet l'approbation des médicaments génériques aux États-Unis en s'appuyant sur les données du médicament d'origine. Il exige bioéquivalence, conformité CMC et certification de brevet, et a permis d'économiser 2 200 milliards de dollars depuis 1984.
Voir plusDifférences entre ingrédients inactifs : les excipients peuvent-ils affecter la sécurité ou l'efficacité des médicaments ?
Les ingrédients inactifs dans les médicaments, appelés excipients, sont souvent considérés comme innocents. Mais des études récentes montrent qu'ils peuvent interagir avec le corps et affecter la sécurité ou l'efficacité des traitements. Voici ce que vous devez savoir.
Voir plusRéponse du gouvernement aux pénuries de médicaments : actions fédérales en 2025-2026
En 2025, les États-Unis font face à plus de 277 pénuries de médicaments critiques. Le gouvernement répond par un réservoir de matières premières, mais les solutions restent insuffisantes. Voici ce qui fonctionne, ce qui échoue, et ce que les patients doivent savoir.
Voir plusComprendre les taux d'événements indésirables : pourcentages et risque relatif dans les essais cliniques
Comprendre les taux d'événements indésirables en clinique : pourquoi le pourcentage simple est trompeur, et comment l'EAIR, méthode recommandée par la FDA, offre une évaluation plus précise du risque.
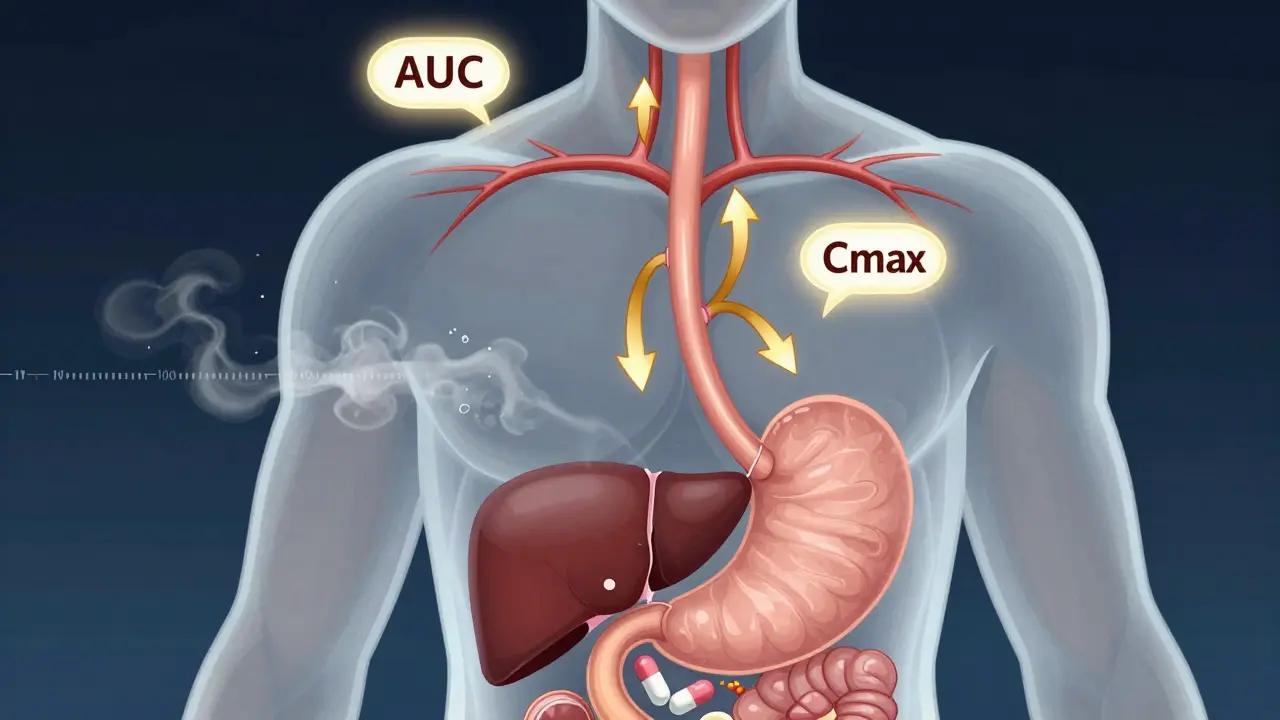
Voir plusComment comparer la biodisponibilité et l'équivalence biologique
Comprendre la biodisponibilité et l'équivalence biologique permet de savoir pourquoi les médicaments génériques sont sûrs et efficaces. Découvrez comment ces concepts sont mesurés, pourquoi ils diffèrent, et ce que cela signifie pour votre traitement.
Voir plusCommunications récentes sur la sécurité des médicaments et rappels de médicaments
Découvrez les dernières alertes de sécurité de la FDA sur les opioïdes, les vaccins mRNA, les stimulants et les traitements de l'Alzheimer. Ce que vous devez savoir pour protéger votre santé.
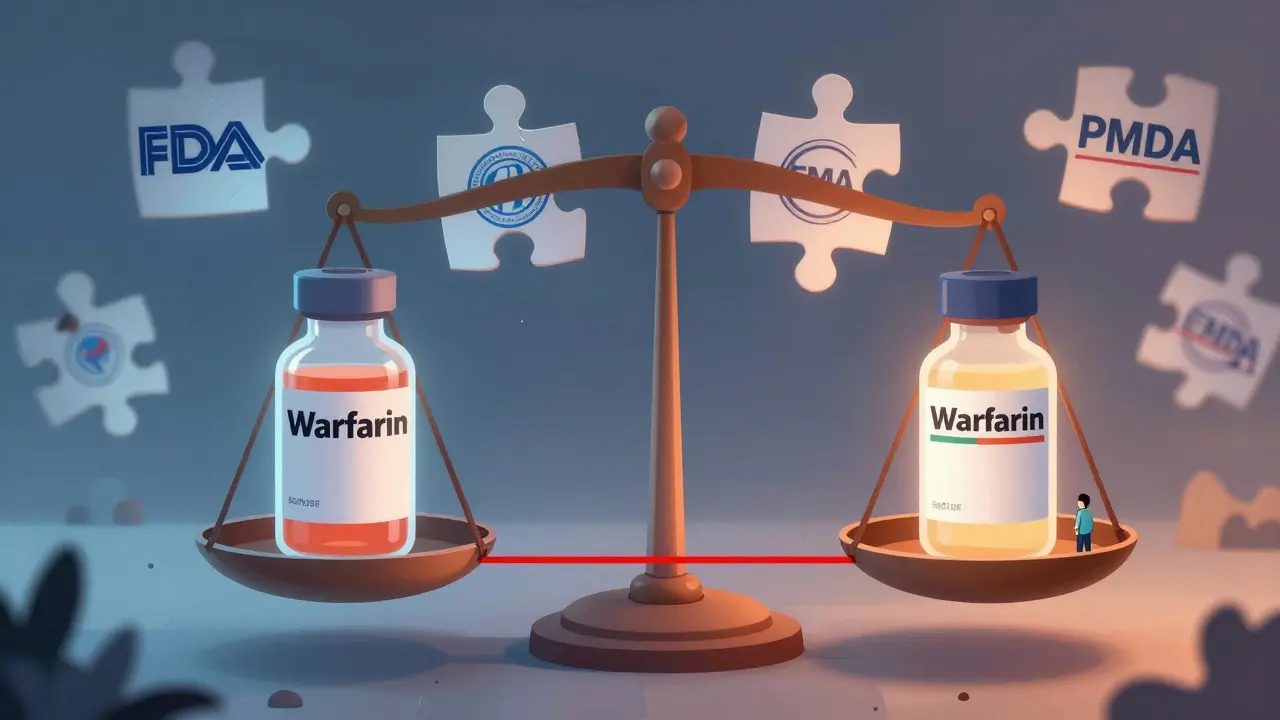
Voir plusApproches réglementaires internationales sur les génériques à indice thérapeutique étroit (NTI)
Les génériques à indice thérapeutique étroit (NTI) comme le warfarin ou la levothyroxine exigent des normes de bioéquivalence beaucoup plus strictes que les génériques classiques. Découvrez comment les États-Unis, l'Europe, le Canada et le Japon régulent ces médicaments critiques pour la sécurité des patients.
Voir plusExclusivité de 180 jours et génériques autorisés : enjeux juridiques aux États-Unis
L'exclusivité de 180 jours pour les génériques aux États-Unis est un levier puissant pour la concurrence, mais les génériques autorisés des laboratoires de marque en affaiblissent l'effet. Découvrez les enjeux juridiques et économiques de cette pratique.
Voir plusCodes d'équivalence thérapeutique : comment la FDA évalue la substituabilité des génériques
Les codes d'équivalence thérapeutique de la FDA déterminent si un générique peut être légalement substitué à un médicament de marque. Explication du système A/B, des codes spécifiques et de leur impact sur la santé et les coûts.
Voir plus