En 2025, le marché des médicaments génériques aux États-Unis repose sur un système ancien mais toujours très actif : l’exclusivité de 180 jours. Ce mécanisme, créé en 1984 par les amendements Hatch-Waxman, a pour but de stimuler les fabricants de génériques à contester les brevets des médicaments de marque. Mais depuis des années, une pratique a émergé qui remet en cause cet équilibre : les génériques autorisés. Ces produits, identiques au médicament de marque, sont commercialisés par le même fabricant, mais sans le nom de marque. Et ils peuvent apparaître dès le premier jour de l’exclusivité. Cela crée un paradoxe juridique : l’incitation à lancer un défi brevetaire est censée être récompensée, mais la récompense est souvent volée par celui qui l’a conçue.
Comment fonctionne l’exclusivité de 180 jours ?
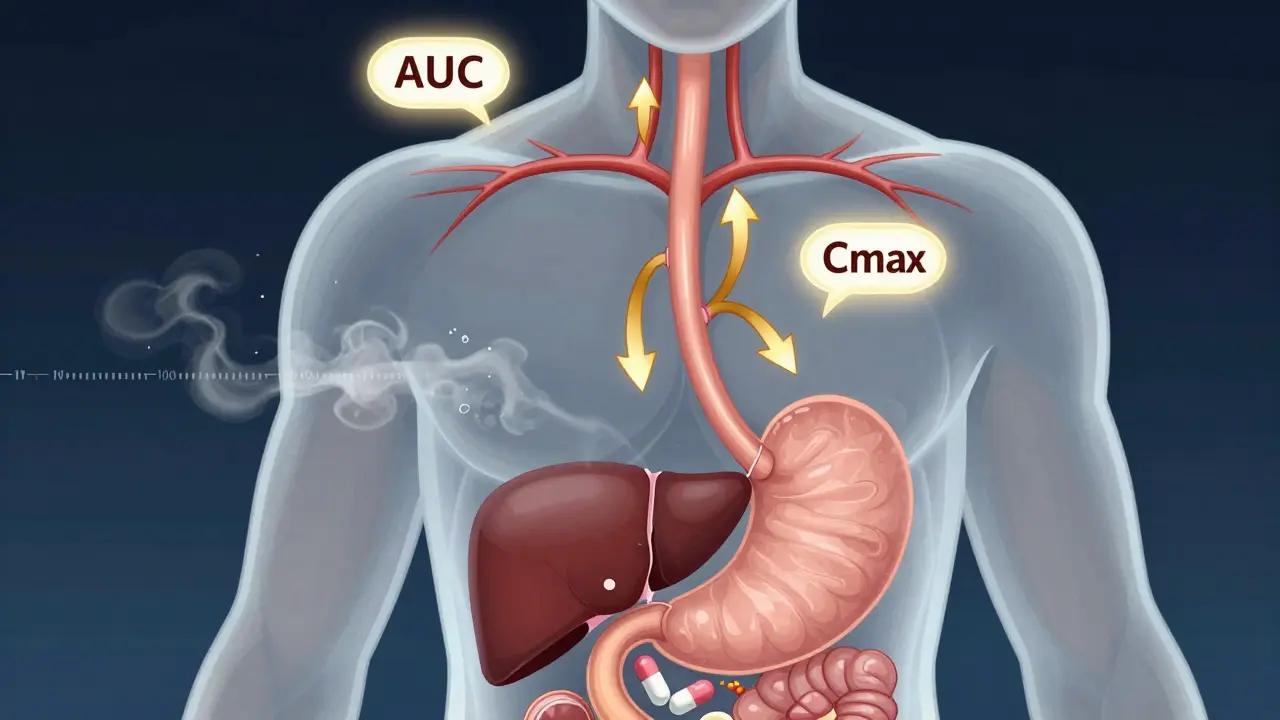
L’exclusivité de 180 jours n’est pas une simple faveur du gouvernement. C’est une récompense légale pour les entreprises qui prennent des risques. Pour y avoir droit, un fabricant de génériques doit déposer une demande d’approbation (ANDA) avec une certification de type Paragraph IV. Cela signifie qu’il affirme qu’un brevet du médicament de marque est invalide ou non enfreint. Ensuite, il doit notifier le détenteur du brevet. Si ce dernier décide de poursuivre en justice, une suspension de 30 mois peut être déclenchée. Mais si le générique gagne le procès - ou si le brevet est annulé - il obtient automatiquement 180 jours d’exclusivité. Pendant cette période, la FDA ne peut approuver aucun autre générique identique.
Ce n’est pas une simple priorité. C’est un monopole. Et ce monopole peut valoir des centaines de millions de dollars. Un seul médicament générique bien placé peut capter jusqu’à 80 % du marché pendant ces six mois. Pour une entreprise comme Teva ou Mylan, c’est une opportunité de revenus massive. Mais ce système ne fonctionne que si personne ne vient briser ce monopole… sauf que quelqu’un le fait : le fabricant de la marque lui-même.
Les génériques autorisés : l’arme secrète des laboratoires de marque
Un générique autorisé n’est pas un vrai générique. C’est le même médicament, fabriqué par la même usine, avec le même processus, la même formule. La seule différence ? Il n’a pas de nom de marque. Il est vendu sous le nom chimique, souvent avec un emballage plus simple. Et il est commercialisé par le laboratoire de marque, pas par le fabricant de génériques.
La loi ne l’interdit pas. La FDA l’autorise. Et elle le fait dès le premier jour où le générique contestataire commence à vendre. Résultat ? Le premier générique ne bénéficie plus d’un monopole. Il doit se battre contre son propre créateur. Dans 60 % des cas entre 2005 et 2015, un générique autorisé a été lancé pendant la période d’exclusivité. Et quand cela arrive, la part de marché du premier générique chute de 80 % à environ 50 %. Cela signifie une perte de 30 à 50 % de ses revenus potentiels.
Imaginez : vous investissez 3 à 5 millions de dollars en procès, vous passez des années à préparer votre ANDA, vous gagnez le droit d’être le seul sur le marché… et soudain, le laboratoire de marque sort sa propre version, à un prix identique ou légèrement inférieur. Vous n’êtes plus le pionnier. Vous êtes un concurrent parmi d’autres. Et vous payez pour avoir osé contester le brevet.
Un système qui pénalise les petits acteurs
Les grandes entreprises de génériques ont les ressources pour négocier. Elles incluent des clauses dans les accords de règlement des brevets pour empêcher les laboratoires de marque de lancer des génériques autorisés. Selon Drug Patent Watch, 78 % des premiers demandeurs de génériques incluent aujourd’hui une telle clause dans leurs accords. Mais les petites entreprises ? Elles n’ont pas cette puissance de négociation. Elles n’ont pas les équipes juridiques pour suivre les détails de la loi. Elles n’ont pas les millions pour attendre un procès.
Sur Reddit, dans des forums professionnels, des développeurs de génériques racontent comment ils ont abandonné des projets après avoir vu les résultats de leurs concurrents. Un post datant de février 2023 résume bien la situation : « Le risque de générique autorisé a rendu les défis de brevets beaucoup moins attractifs pour les PME. » Pour elles, le coût du défi dépasse souvent les gains possibles. Et si le laboratoire de marque décide de lancer un générique autorisé, le risque devient une certitude de perte.

Les conséquences économiques et juridiques
Entre 2015 et 2020, les premiers génériques n’ont capté en moyenne que 52 % de leurs revenus potentiels à cause des génériques autorisés. Cela signifie que le système original, conçu pour accélérer l’accès aux médicaments bon marché, fonctionne moins bien qu’avant. L’Association for Accessible Medicines estime que depuis 1984, les génériques ont permis d’économiser 2,2 billions de dollars aux États-Unis. Mais cette économie est menacée par une pratique qui affaiblit l’incitation à entrer sur le marché.
La Federal Trade Commission (FTC) a déposé 15 poursuites antitrust entre 2010 et 2022 contre des laboratoires de marque pour avoir utilisé les génériques autorisés comme un outil de retardement de la concurrence. Selon la FTC, cette pratique crée un « détour juridique » : au lieu de payer pour un règlement de brevet, les laboratoires de marque utilisent un outil légal pour écraser la concurrence dès son arrivée.
En 2023, le commissaire de la FDA, Robert Califf, a déclaré devant le Sénat que le système actuel « crée des désincitations non intentionnelles à l’entrée rapide des génériques ». Il a ajouté que l’agence soutient une modification de la loi pour empêcher les génériques autorisés pendant la période d’exclusivité. Ce n’est pas une opinion isolée. L’IQVIA note que le délai moyen avant l’arrivée de plusieurs génériques sur le marché est passé de 28 mois en 2000 à seulement 9 mois en 2022 - une accélération due en partie à la stratégie des génériques autorisés.
La législation en cours : un changement imminent ?
Depuis 2009, plusieurs projets de loi ont été déposés pour interdire les génériques autorisés pendant la période d’exclusivité. Le plus récent, le Preserve Access to Affordable Generics and Biosimilars Act (S. 1665/H.R. 3928), a été réintroduit en 2023. Il vise à fermer cette faille légale. Si cette loi passe, les laboratoires de marque ne pourront plus lancer leur propre version générique pendant les 180 jours. Cela redonnerait aux premiers génériques leur pouvoir réel.
Les analystes de Leerink Partners estiment que si cette loi est adoptée, la valeur d’un défi brevetaire réussi augmenterait de 150 à 250 millions de dollars par médicament. Cela pourrait pousser 20 à 25 % de plus d’entreprises à lancer des défis. Pour les patients, cela signifierait plus de concurrence, plus de baisse des prix, et plus de transparence.
Les laboratoires de marque répondent qu’un générique autorisé fait baisser les prix plus vite. Une étude RAND de 2021 montre que les prix sont en moyenne 15 à 25 % plus bas quand un générique autorisé est présent. Mais ce n’est pas la même chose que d’avoir une véritable concurrence. C’est la même entreprise qui vend deux versions du même produit. Le consommateur paie moins, mais le marché ne devient pas plus compétitif.

Les erreurs courantes et comment les éviter
Pour les fabricants de génériques, le piège n’est pas seulement le générique autorisé. C’est aussi la mauvaise gestion de l’exclusivité. La FDA précise que la période de 180 jours commence au moment où le générique est commercialement commercialisé - c’est-à-dire lorsqu’il est expédié à un client. Beaucoup d’entreprises pensent que c’est à la date d’approbation de la FDA. Ce n’est pas le cas. Si vous attendez trop longtemps pour lancer votre produit, vous perdez du temps précieux.
Entre 2018 et 2022, 28 % des premiers demandeurs ont perdu une partie de leur exclusivité à cause d’erreurs administratives. Les petites entreprises, en particulier, ne disposent pas des équipes dédiées pour gérer les délais, les documents, les communications avec la FDA. Le conseil des experts ? Mettre en place une équipe dédiée, avec des responsables juridiques, réglementaires et commerciaux, au moins six mois avant l’approbation prévue. Pour les grandes entreprises, cela représente un investissement de 500 000 à 1 million de dollars. Pour les petites, c’est souvent impossible.
Que faire maintenant ?
En 2025, le système reste en place. Les génériques autorisés sont toujours autorisés. Les laboratoires de marque continuent de les utiliser. Les petits fabricants de génériques restent en difficulté. Mais les signaux changent. Le Congrès est plus attentif. La FTC est plus active. La FDA a changé de ton.
Si vous êtes un fabricant de génériques, vous devez maintenant évaluer chaque défi de brevet en tenant compte du risque de générique autorisé. Est-ce que le médicament est rentable ? Est-ce que le laboratoire de marque a déjà lancé un générique autorisé pour un autre produit ? Est-ce que vous avez les moyens de négocier une clause de non-lancement ? Si la réponse est non, il vaut peut-être mieux ne pas engager le procès.
Si vous êtes un patient, un professionnel de santé ou un décideur en santé publique, vous devez comprendre que le prix bas d’un générique n’est pas toujours le signe d’une concurrence saine. Parfois, c’est juste une stratégie de la marque pour garder le contrôle. Et tant que la loi ne change pas, ce système continuera de pénaliser ceux qui tentent de le réformer.
La balle est maintenant dans le camp du législateur. Le système Hatch-Waxman a permis d’économiser des milliards. Mais il ne peut plus fonctionner comme il le faisait en 1984. Le monde a changé. La concurrence n’est plus la même. Et la loi doit suivre.
Qu’est-ce qu’un générique autorisé ?
Un générique autorisé est un médicament identique au produit de marque, fabriqué par le même laboratoire, avec la même formule et le même processus. La seule différence est qu’il est vendu sans le nom de marque, souvent avec un emballage plus simple. Il n’a pas besoin d’être approuvé par la FDA comme un générique classique, car il est déjà approuvé sous le nom de marque.
Pourquoi les laboratoires de marque lancent-ils des génériques autorisés ?
Ils le font pour conserver leur part de marché et éviter que le premier générique ne capture la totalité des ventes. En lançant leur propre version, ils peuvent vendre à un prix compétitif tout en restant le principal bénéficiaire des revenus. Cela réduit les gains du générique contestataire et limite la concurrence réelle sur le marché.
L’exclusivité de 180 jours peut-elle être partagée ?
Oui. Depuis 2003, plusieurs fabricants peuvent partager l’exclusivité s’ils déposent leur demande le même jour et qu’ils sont tous les premiers à avoir déposé une certification Paragraph IV. Mais cela reste rare, car il faut que plusieurs entreprises aient préparé leur dossier simultanément, ce qui demande une coordination extrêmement précise.
Quand commence exactement la période d’exclusivité ?
Elle commence au moment où le générique est commercialement commercialisé, c’est-à-dire lorsqu’il est expédié pour la première fois à un client ou à un distributeur. Ce n’est pas à la date d’approbation de la FDA, ni à la date du jugement. La FDA considère que la vente réelle, et non la simple autorisation, déclenche la période.
Les génériques autorisés sont-ils illégaux ?
Non, ils sont parfaitement légaux. La loi ne les interdit pas. La FDA les autorise. Mais leur usage pendant la période d’exclusivité est de plus en plus contesté. Des projets de loi sont en cours pour les interdire dans ce contexte, mais aucune loi n’a encore été adoptée en 2025.
Comment les petites entreprises peuvent-elles survivre dans ce système ?
Elles doivent se concentrer sur des médicaments où le risque de générique autorisé est faible - par exemple, des produits avec des brevets faibles, ou des laboratoires de marque qui n’ont jamais lancé de générique autorisé. Elles peuvent aussi chercher à collaborer avec d’autres petites entreprises pour partager les coûts de litige. Mais la réalité est que sans protection légale contre les génériques autorisés, leur capacité à entrer sur le marché reste très limitée.



Jonas Jatsch
décembre 2, 2025 AT 03:12Je trouve ça fou que les grandes pharma puissent faire ça. Tu investis des millions, tu te bats en justice pendant des années, tu gagnes, et d’un coup, c’est eux qui te piquent ton monopole avec leur version ‘générique’… sans même avoir à risquer un centime. C’est comme si tu construisais une route, et que ton voisin la prende et la vende comme s’il l’avait faite. La loi est censée protéger l’innovation, pas la trahir. Et on parle de médicaments, pas de smartphones. Des gens meurent parce que les prix sont trop hauts, et maintenant on leur enlève la seule arme qui pouvait les rendre abordables. C’est une honte.
Je suis médecin en Suisse, je vois tous les jours les familles qui choisissent entre leur traitement et leur loyer. Ce système, c’est une machine à enrichir les riches en sacrifiant les pauvres. Et la FDA, au lieu de réagir, regarde ailleurs. Pourquoi ? Parce que les lobbyistes paient mieux que les patients. Je ne comprends pas comment on peut encore appeler ça une démocratie.
Il faut que le Congrès agisse. Pas dans 5 ans. Maintenant. Si cette loi S.1665 passe, ça pourrait sauver des milliers de vies. Et si elle échoue ? Alors on arrête de parler d’accès aux soins. On dit la vérité : aux États-Unis, la santé est un luxe. Et les génériques autorisés, c’est juste le masque d’un système corrompu.
Je suis épuisé de voir ça se répéter. Chaque année, un nouveau médicament devient un champ de bataille entre Big Pharma et les petits fabricants. Et chaque fois, les patients paient le prix fort. Pas en dollars, en souffrance. En insomnies. En dettes. En morts prématurées.
Je ne suis pas un activiste. Je suis juste un témoin. Et je dis : ça suffit.
Kate Orson
décembre 2, 2025 AT 13:31HAHAHAHA 😂😂😂 FRANCE ET SUISSE EN COLLABO POUR DÉTRUIRE L'AMÉRIQUE ?!?!? 😭
Les Américains sont des naïfs ! Ils croient encore que la loi est juste ?! T’as vu les gars qui font des génériques ? Des petits types avec des lunettes et des calculatrices, alors que les big pharma ont des avions privés et des lawyers à 1000$/h !
Et tu veux qu’on leur donne encore plus d’argent ?! Non. On leur donne un générique autorisé, et on leur dit : ‘Tu veux concurrencer ? Vas-y, mais avec ton propre nom de marque !’ 😎
Je dis : laissez les Américains se débrouiller. Ils ont les médicaments les plus chers du monde… et maintenant ils veulent aussi que ça soit ‘équitable’ ?! 😂😂😂
Le vrai problème, c’est qu’ils ne veulent pas payer 1000$ pour un médicament… mais ils veulent qu’il soit bon. C’est ça le vrai défi. Pas les génériques. Leur gueule.
Nicole Gamberale
décembre 2, 2025 AT 16:31Oh mon Dieu, encore ce débat de bourgeois qui pense que la morale est une question de brevets ? 😒
Vous êtes tous en train de pleurer sur la ‘justice’ alors que la vérité, c’est que les laboratoires de marque sont des voleurs, mais les ‘génériques’ ? Des opportunistes en blouse blanche. Ils ne veulent pas sauver les patients, ils veulent leur part du gâteau. Et quand ils ne l’ont pas, ils crient au scandale.
Le vrai scandale, c’est que les Américains paient 10 fois plus pour un médicament que les Européens… et ils veulent encore plus de concurrence ?! Non. Ils veulent que quelqu’un d’autre paie pour eux.
Et puis, arrêtez avec ce mythe du ‘petit fabricant courageux’. La plupart de ces entreprises sont des filiales de fonds d’investissement basés à Cayman. Ils n’ont pas d’usine. Ils n’ont pas d’employés. Ils ont un avocat et un compte offshore.
Le vrai héros, c’est le patient qui paie 20$ pour un générique en France… sans avoir à faire un procès. La solution ? Supprimer les brevets. Pas les génériques autorisés. Les brevets. Point.
Et si vous voulez un vrai changement, arrêtez de pleurer sur Reddit. Allez dans un hôpital. Parlez à un infirmier. Il vous dira que les patients meurent parce qu’ils n’ont pas de mutuelle… pas parce qu’un générique a été ‘volé’.
Alexis Butler
décembre 4, 2025 AT 13:26Vous confondez la loi avec la morale, et la concurrence avec la justice. C’est une erreur fondamentale, et ça vous rend vulnérables aux discours populistes.
L’exclusivité de 180 jours n’est pas un droit naturel. C’est un privilège réglementaire, conçu pour stimuler la contestation des brevets - pas pour créer des monopoles de fait. Le générique autorisé n’est pas un abus : c’est une application légitime du cadre juridique. La FDA l’autorise, la loi le permet, et les tribunaux l’ont validé à plusieurs reprises.
La vraie question, c’est : pourquoi les fabricants de génériques n’ont-ils pas anticipé ce risque ? Parce qu’ils pensaient que le système était ‘équitable’ ? C’est naïf. Le marché est un champ de bataille. Si vous ne protégez pas vos intérêts dans les contrats, vous n’avez pas votre place.
Les petites entreprises ? Elles n’ont pas de problème de loi. Elles ont un problème de stratégie. Elles veulent jouer au poker sans savoir lire les cartes. Le générique autorisé n’est pas une faille. C’est une leçon.
Et puis, arrêtez de croire que les prix bas = justice sociale. Un prix bas obtenu par un monopole de fait (le premier générique) est aussi pervers qu’un prix haut. La vraie concurrence, c’est quand plusieurs acteurs entrent sur le marché. Pas quand un seul a un avantage artificiel.
La solution n’est pas d’interdire les génériques autorisés. C’est de réformer le système pour que l’exclusivité soit conditionnée à l’absence de collusion. Et si vous voulez une vraie réforme, arrêtez de vous plaindre sur Reddit. Lisez la loi. Comprenez-la. Et ensuite, parlez.
Clementine McCrowey
décembre 4, 2025 AT 15:37Je ne suis pas expert, mais j’ai vu un ami perdre son travail à cause de ça. Il travaillait pour une petite boîte qui a investi dans un générique… et puis le grand laboratoire a sorti leur version. Il a perdu son job. En 2 semaines. Personne ne l’a appelé. Personne ne l’a aidé.
Je pense que les gens qui font des médicaments méritent d’être protégés. Pas les grandes entreprises. Les gens. Les employés. Les familles.
Je ne sais pas comment changer la loi. Mais je sais qu’on ne peut pas laisser quelqu’un perdre tout pour avoir eu le courage de dire ‘je vais essayer’.
Je crois qu’on peut faire mieux.