Vous avez entendu parler de biosimilaires ou de génériques comme des alternatives moins chères à vos médicaments coûteux. Mais sont-ils vraiment interchangeables ? Est-ce que choisir l’un plutôt que l’autre peut affecter votre traitement ? La réponse n’est pas aussi simple qu’on le croit. Les deux réduisent les coûts, mais ils ne sont pas la même chose. Comprendre la différence peut vous aider à prendre une décision éclairée - avec votre médecin - sans sacrifier votre santé.
Qu’est-ce qu’un générique ?
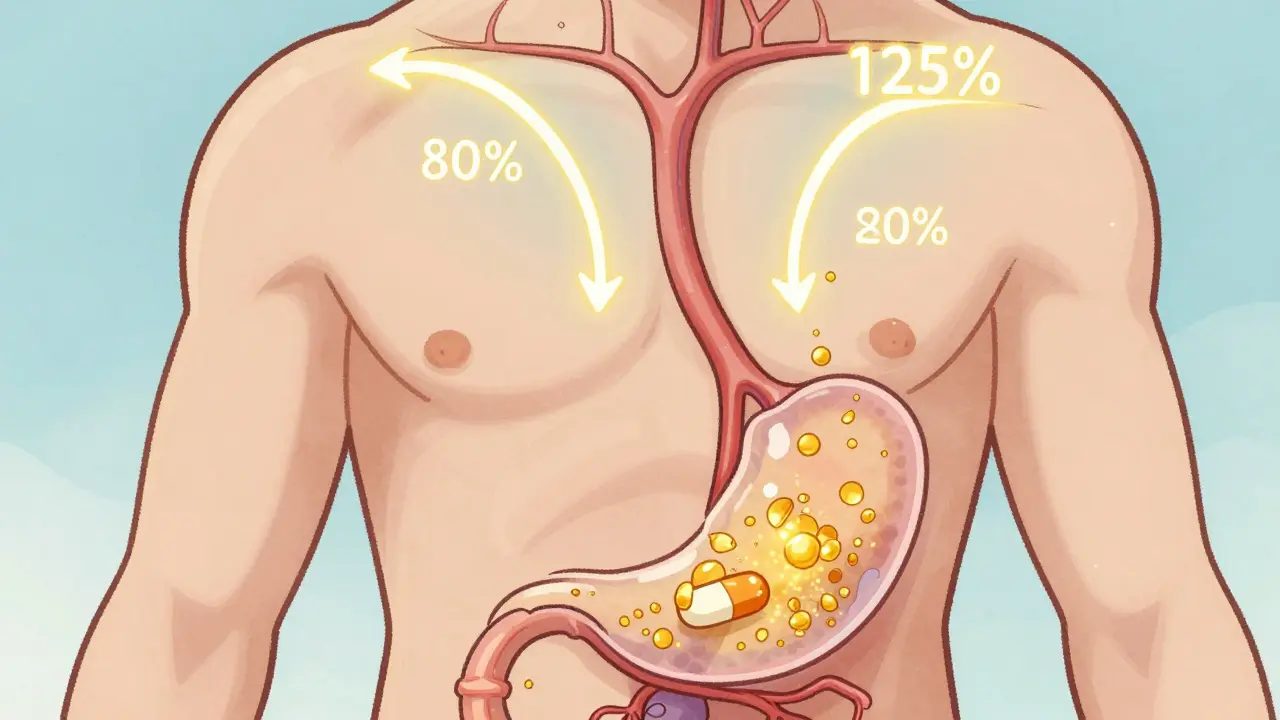
Un générique, c’est la version économique d’un médicament traditionnel, comme le atorvastatine (générique du Lipitor) ou le lévothyroxine (générique du Synthroid). Ces médicaments sont fabriqués à partir de molécules chimiques simples, de petite taille (moins de 1 000 daltons). Leur structure est parfaitement connue, et on peut la reproduire exactement dans un laboratoire. C’est pourquoi les génériques doivent être identiques à leur version de marque : même principe actif, même dose, même forme (comprimé, gélule, sirop), même manière d’être absorbée par le corps.Pour être approuvé, un générique doit prouver qu’il se comporte de la même manière que le médicament d’origine dans le corps. On appelle ça la bioéquivalence. Cela signifie que la quantité de médicament qui entre dans votre sang (AUC) et la vitesse à laquelle elle y arrive (Cmax) doivent être dans une fourchette très précise : entre 80 % et 125 % de la version originale. Des centaines d’études ont confirmé que les génériques sont aussi efficaces et sûrs que les médicaments de marque. Une étude majeure publiée dans JAMA en 2019, qui a analysé 47 essais cliniques sur des médicaments cardiaques, n’a trouvé aucune différence significative entre les génériques et les versions de marque.
Le coût ? Généralement, un générique coûte 80 à 85 % moins cher que le médicament d’origine. C’est pourquoi 90 % des prescriptions aux États-Unis sont aujourd’hui pour des génériques. Dans la plupart des États, votre pharmacien peut vous remplacer automatiquement le médicament de marque par son générique, sauf si votre médecin a écrit « dispense as written » sur l’ordonnance.
Et les biosimilaires, c’est quoi ?
Les biosimilaires, eux, sont une autre catégorie. Ils ne sont pas des copies exactes. Ce sont des médicaments issus de cellules vivantes - des protéines complexes, souvent de plus de 10 000 daltons. Des exemples ? L’adalimumab (générique du Humira), le trastuzumab (générique du Herceptin), ou l’insuline glargine (générique du Lantus). Ces molécules sont produites dans des cultures de cellules (comme des cellules de hamster chinois), ce qui les rend extrêmement sensibles aux petites variations dans le processus de fabrication.Parce qu’elles sont vivantes, ces protéines ne peuvent jamais être reproduites à l’identique. C’est pourquoi les biosimilaires ne sont pas appelés « génériques » - ils sont « hautement similaires » à la version d’origine, mais pas identiques. Pour être approuvé, un biosimilaire doit passer des tests bien plus complets : analyse structurale détaillée (spectrométrie de masse, chromatographie), études sur des animaux, et des essais cliniques limités pour prouver qu’il n’y a aucune différence cliniquement significative en termes de sécurité, d’efficacité ou de pureté.
Le coût ? Moins impressionnant que pour les génériques. Un biosimilaire coûte en moyenne 15 à 20 % moins cher que le médicament de référence. Ce n’est pas une économie de 80 %, mais c’est quand même une réduction importante pour des traitements qui peuvent coûter plus de 10 000 $ par an - comme ceux utilisés pour le cancer ou les maladies auto-immunes.
Les différences clés à connaître
Voici un résumé simple des différences essentielles :
| Caractéristique | Générique | Biosimilaire |
|---|---|---|
| Type de molécule | Chimique, petite (moins de 1 000 daltons) | Protéine, grande (plus de 10 000 daltons) |
| Production | Synthèse chimique | Cultures cellulaires vivantes |
| Équivalence | Identique | Hautement similaire |
| Coût d’achat | 80-85 % moins cher | 15-20 % moins cher |
| Stockage | Fréquemment à température ambiante | 2-8°C (réfrigération obligatoire) |
| Substitution en pharmacie | Autorisée dans 49 États (sauf indication contraire) | Seulement pour les biosimilaires « interchangeables » et avec notification au prescripteur dans 28 États |
| Exemples courants | Atorvastatine, lévothyroxine, metformine | Adalimumab, trastuzumab, infliximab, insuline glargine |
La complexité des biosimilaires signifie aussi que leur développement coûte entre 100 et 250 millions de dollars - contre 2 à 3 millions pour un générique. C’est pourquoi il faut plus de 8 à 10 ans pour les mettre sur le marché, contre 3 à 4 ans pour un générique.
Quand choisir l’un ou l’autre ?
Si votre traitement est un médicament à base de molécule chimique - comme un antihypertenseur, un antidouleur, ou un traitement de l’hypothyroïdie - alors un générique est la meilleure option. Il est sûr, éprouvé, et très peu coûteux. Il n’y a aucune raison de payer plus cher.
Si vous prenez un traitement biologique - pour le cancer, la polyarthrite rhumatoïde, la maladie de Crohn, ou le diabète de type 1 - alors un biosimilaire peut être une excellente alternative. Ces médicaments n’ont pas de génériques, car leur structure est trop complexe. Les biosimilaires sont les seules options économiques disponibles. Des études réelles sur des dizaines de milliers de patients (comme celles sur l’infliximab pour la maladie inflammatoire de l’intestin) montrent que les biosimilaires fonctionnent aussi bien que les versions de marque, sans augmentation des effets secondaires.
La Société américaine de rhumatologie recommande même les biosimilaires comme traitement de première ligne pour la polyarthrite rhumatoïde. Et dans le cancer, les biosimilaires comme le trastuzumab permettent à des patients qui ne pouvaient plus se permettre le traitement de continuer leur thérapie.
Les préoccupations des patients
Beaucoup de patients hésitent à passer à un biosimilaire. Une enquête de la National Psoriasis Foundation en 2022 a montré que 42 % des patients avaient peur que le biosimilaire ne soit pas aussi efficace. Ce sont souvent des craintes liées à la complexité du produit, pas à des preuves réelles.
Un patient atteint de cancer du côlon a écrit sur un forum en novembre 2023 : « Mon oncologue m’a changé vers le biosimilaire du bevacizumab. Mes marqueurs tumoraux sont restés stables, et mes frais personnels sont passés de 450 $ à 75 $ par perfusion. »
En revanche, un autre patient atteint de maladie inflammatoire de l’intestin a rapporté une anxiété accrue après le changement - même si ses résultats médicaux étaient identiques. La peur vient souvent du manque d’information. Un bon médecin ou pharmacien peut rassurer en expliquant la science derrière le biosimilaire.
Les dispositifs d’administration peuvent aussi poser problème. Un biosimilaire d’insuline peut avoir un stylo différent de la version originale. Pour les personnes âgées, cela peut entraîner des erreurs d’administration. Il faut donc s’assurer que le patient reçoit une formation adaptée.
Que dit la réglementation ?
L’Agence américaine des médicaments (FDA) a mis en place des normes très strictes pour les deux types de médicaments. Pour les génériques, le processus est éprouvé depuis 1984. Pour les biosimilaires, la loi de 2010 a créé un nouveau cadre, mais les exigences sont tout aussi rigoureuses - même si elles sont différentes.
La FDA exige que les biosimilaires soient testés sur des milliers de patients avant d’être approuvés. Les données montrent que les taux d’effets indésirables sont presque identiques à ceux des médicaments d’origine. Une analyse de 2022 a révélé que les biosimilaires d’infliximab avaient 0,12 événement indésirable pour 100 patient-années, contre 0,15 pour la version originale - une différence statistiquement insignifiante.
Depuis 2021, la FDA a approuvé les premiers biosimilaires « interchangeables » - c’est-à-dire ceux qui peuvent être remplacés sans consultation du médecin, comme l’insuline Semglee ou le Cyltezo pour le Humira. Ces produits ont été testés pour des changements répétés entre la version originale et le biosimilaire, sans effet négatif.
Le rôle du médecin et du pharmacien
Beaucoup de médecins généralistes ne se sentent pas à l’aise avec les biosimilaires. Un sondage de l’American Medical Association en 2023 a montré que seulement 58 % d’entre eux se sentaient « très confiants » pour les prescrire, contre 89 % pour les génériques. Pourtant, les spécialistes - oncologues, rhumatologues - les utilisent couramment.
La clé, c’est la communication. Si votre médecin vous propose un biosimilaire, demandez-lui pourquoi. Est-ce une question de coût ? De disponibilité ? De protocole hospitalier ? Une bonne réponse devrait inclure des données concrètes : « Voici les études qui prouvent que ce biosimilaire fonctionne aussi bien que le médicament que vous prenez. »
Le pharmacien, lui, joue un rôle crucial dans la substitution. Dans certains États, il doit vous avertir s’il change votre médicament. Dans d’autres, il peut le faire automatiquement pour les génériques. Pour les biosimilaires, même interchangeables, il doit souvent informer votre médecin dans les 72 heures.
Comment bien démarrer ?
Si vous êtes éligible pour un changement :
- Discutez avec votre médecin : demandez si un générique ou un biosimilaire est possible pour votre traitement.
- Vérifiez votre couverture d’assurance : certains plans favorisent les biosimilaires en réduisant votre part personnelle.
- Demandez des informations : demandez à votre pharmacien ou à votre hôpital s’il existe un programme de soutien (comme ceux d’Amgen ou de Pfizer) pour vous aider financièrement ou vous former à l’usage du nouveau dispositif.
- Surveillez votre état : notez tout changement - même minime - dans vos symptômes, votre énergie, ou vos effets secondaires après le changement.
- Ne paniquez pas si vous avez des doutes : la plupart des changements se font sans problème. Mais si vous avez peur, parlez-en. Votre traitement ne doit pas être une source de stress.
Et demain ?
Le marché des biosimilaires explose. En 2023, il valait 12,4 milliards de dollars. Il devrait atteindre 58,7 milliards d’ici 2030. Plus de 45 % des traitements biologiques pourraient être des biosimilaires d’ici 2027. De nouveaux produits comme le biosimilaire du Stelara (ustekinumab) sont attendus en 2024 - et pourraient faire économiser 5 milliards de dollars par an aux États-Unis.
La loi sur la réduction de l’inflation de 2022 a aussi aidé : elle a supprimé une pénalité financière pour les hôpitaux qui utilisent des biosimilaires. Résultat ? Une utilisation qui augmente de 25 %.
Les défis restent : des brevets complexes ralentissent encore l’arrivée de certains biosimilaires. Certains fabricants de médicaments de marque utilisent des stratégies juridiques pour retarder la concurrence. Mais la tendance est claire : les biosimilaires ne sont plus une exception. Ils deviennent la norme pour les traitements coûteux.
Les biosimilaires sont-ils aussi sûrs que les médicaments de marque ?
Oui. Les biosimilaires doivent passer des tests rigoureux avant d’être approuvés par la FDA, y compris des études cliniques sur des milliers de patients. Les données montrent qu’ils ont des taux d’effets secondaires et d’efficacité presque identiques à ceux des médicaments d’origine. Une étude de 2022 a montré que les biosimilaires d’infliximab avaient un taux d’effets indésirables presque identique à celui du produit original.
Pourquoi les biosimilaires coûtent-ils moins cher que les médicaments de marque, mais pas autant que les génériques ?
Parce que leur fabrication est beaucoup plus complexe. Un générique est une molécule chimique simple, facile à reproduire. Un biosimilaire est une protéine vivante, produite dans des cellules. Cela demande des installations spécialisées, des contrôles très précis, et des essais cliniques plus longs. Le coût de développement peut atteindre 250 millions de dollars - contre 3 millions pour un générique.
Puis-je être changé de mon médicament sans mon accord ?
Pour les génériques, oui, dans la plupart des États - sauf si votre médecin a écrit « dispense as written ». Pour les biosimilaires, seuls ceux classés comme « interchangeables » peuvent être substitués sans autorisation explicite. Même alors, dans 28 États, le pharmacien doit informer votre médecin dans les 72 heures. Vous avez toujours le droit de refuser le changement.
Les biosimilaires peuvent-ils provoquer des réactions immunitaires ?
C’est une préoccupation théorique, mais les données réelles ne le confirment pas. Les biosimilaires sont conçus pour minimiser les différences qui pourraient déclencher une réponse immunitaire. Des études sur plus de 38 000 patients n’ont pas montré d’augmentation des anticorps ou des réactions allergiques comparées aux médicaments d’origine.
Que faire si je n’ai pas de médecin pour m’aider à choisir ?
Contactez votre pharmacien. Il peut vous expliquer les différences entre les options disponibles, vérifier si votre assurance couvre un biosimilaire ou un générique, et vous orienter vers des programmes d’aide financière. Beaucoup de fabricants proposent des services gratuits d’accompagnement pour les patients qui changent de traitement.

Noé García Suárez
novembre 19, 2025 AT 14:55Les biosimilaires, c’est pas juste une question de coût - c’est une révolution pharmacologique. La complexité des protéines recombinantes rend leur production un chef-d’œuvre d’ingénierie biologique. On parle de micro-hétérogénéités post-traductionnelles, de glycosylation variable, de conformations tridimensionnelles sensibles à la température. Et pourtant, la FDA et l’EMA exigent une similarité structurelle et fonctionnelle à 99,5 %, validée par des assays de liaison, des études de stabilité accélérée, et des essais de non-infériorité sur des cohortes de plus de 10 000 patients. Ce n’est pas du « copier-coller » - c’est de la réplication de la nature. Et ça, c’est de la science, pas du marketing.
Rudi Timmermans
novembre 21, 2025 AT 01:40Je trouve ça génial qu’on parle enfin de ça sans peur. Mon père est sous adalimumab depuis 5 ans, et il a passé au biosimilaire il y a deux ans. Rien de changé. Pas de perte d’efficacité, pas de réaction immunitaire. Juste une facture divisée par trois. Les gens ont peur de ce qu’ils ne comprennent pas, mais la science est là. Faut juste que les médecins prennent le temps d’expliquer - pas juste dire « c’est pareil ».
Nathalie Garrigou
novembre 22, 2025 AT 21:58Ah oui bien sûr, « c’est pareil »… comme les vaccins Pfizer et les vaccins « biosimilaires » de l’OMS, hein ? 😏 Vous croyez vraiment que les multinationales vont laisser tomber leurs brevets pour la santé des pauvres ? Les biosimilaires, c’est juste une autre façon de vous vendre un produit avec un nouveau nom et un prix encore plus élevé après 2 ans. Attendez qu’ils lancent le « biosimilaire du biosimilaire »… et vous verrez.
Maxime ROUX
novembre 24, 2025 AT 03:30Franchement, les génériques c’est du pain bénit. J’ai pris de l’atorvastatine pendant 4 ans, zéro problème. Le biosimilaire, c’est pour les trucs ultra-chers genre Humira, ou les traitements de cancer. Mais tu veux un truc simple ? Générique. Pas besoin de faire un doctorat pour comprendre que 80 % de moins, c’est pas un hasard. Et si t’as peur, demande à ton pharmacien - il sait mieux que ton médecin ce qui est en stock.
Christine Caplan
novembre 25, 2025 AT 15:04Vous savez quoi ? C’est une chance incroyable qu’on ait accès à ça. 🙌 J’ai un ami avec une maladie auto-immune qui ne pouvait plus payer son traitement avant les biosimilaires. Aujourd’hui, il voyage, il travaille, il vit. C’est pas juste de la chimie - c’est de l’humanité. Oui, il faut s’informer, oui, il faut poser des questions, mais ne laissez pas la peur vous empêcher de profiter de cette avancée. Vous méritez de vivre sans être ruiné. 💪
Justine Anastasi
novembre 26, 2025 AT 16:19Et si tout ça, c’était un piège ? Les laboratoires ont toujours voulu contrôler le corps. Les génériques, c’était déjà une tromperie - on vous donnait la même molécule, mais avec un excipient différent pour altérer l’absorption. Les biosimilaires ? C’est la même logique, mais en version 2.0. Des protéines vivantes ? Qui a dit qu’elles étaient stables ? Qui a vérifié les effets à long terme sur le microbiote ? Personne. On vous donne des chiffres, mais pas les données brutes. Et si la « similarité » était une illusion ?
Jean Yves Mea
novembre 28, 2025 AT 16:12Le vrai enjeu, c’est la transparence. On parle beaucoup de bioéquivalence, mais qui vérifie les chaînes de production ? Qui contrôle les lots ? Et si un biosimilaire est fabriqué dans un pays où les normes sont plus souples ? Le fait que la FDA approuve ne signifie pas que tout est parfait - ça signifie juste que ça passe la barre légale. Ce qu’il faut, c’est un registre public ouvert, avec les données de chaque lot. Pas juste des résumés marketing.
Les Gites du Gué Gorand
novembre 28, 2025 AT 20:08Je suis pharmacien dans un petit village. Les patients ont peur de changer. Je leur montre les études, je leur explique les différences, je leur donne des brochures. Et puis je leur dis : « Si vous avez un doute, on peut revenir en arrière. » La plupart ne le font pas. Parce qu’ils comprennent enfin que c’est pas une expérience, c’est une option. Et c’est ça, la santé : des choix éclairés, pas des peurs aveugles.
clement fauche
novembre 30, 2025 AT 07:38Et si les biosimilaires étaient une arme de guerre économique ? Les États-Unis les imposent pour réduire les coûts de la Sécurité sociale. En France, on les limite. Pourquoi ? Parce que les laboratoires paient des lobbyistes. Et si les médecins ne les prescrivent pas, c’est parce qu’ils sont payés pour garder les traitements chers ? Les données officielles disent qu’ils sont sûrs. Mais qui a financé ces données ?
Nicole Tripodi
novembre 30, 2025 AT 19:03