Vous avez peut-être remarqué que votre pharmacien vous propose un médicament générique au lieu du brand. Vous vous demandez : est-ce vraiment pareil ? La réponse repose sur deux concepts clés : biodisponibilité et équivalence biologique. Ce ne sont pas des mots techniques pour les scientifiques - ce sont des garanties de sécurité pour vous.
Qu’est-ce que la biodisponibilité ?
La biodisponibilité, c’est la part du médicament qui entre vraiment dans votre sang après que vous l’avez pris. Imaginez que vous avalez une pilule. Ce n’est pas parce qu’elle est dans votre estomac qu’elle agit. Une partie peut être détruite par votre foie, une autre ne passe pas bien à travers votre intestin. La biodisponibilité mesure ce qui reste utile.
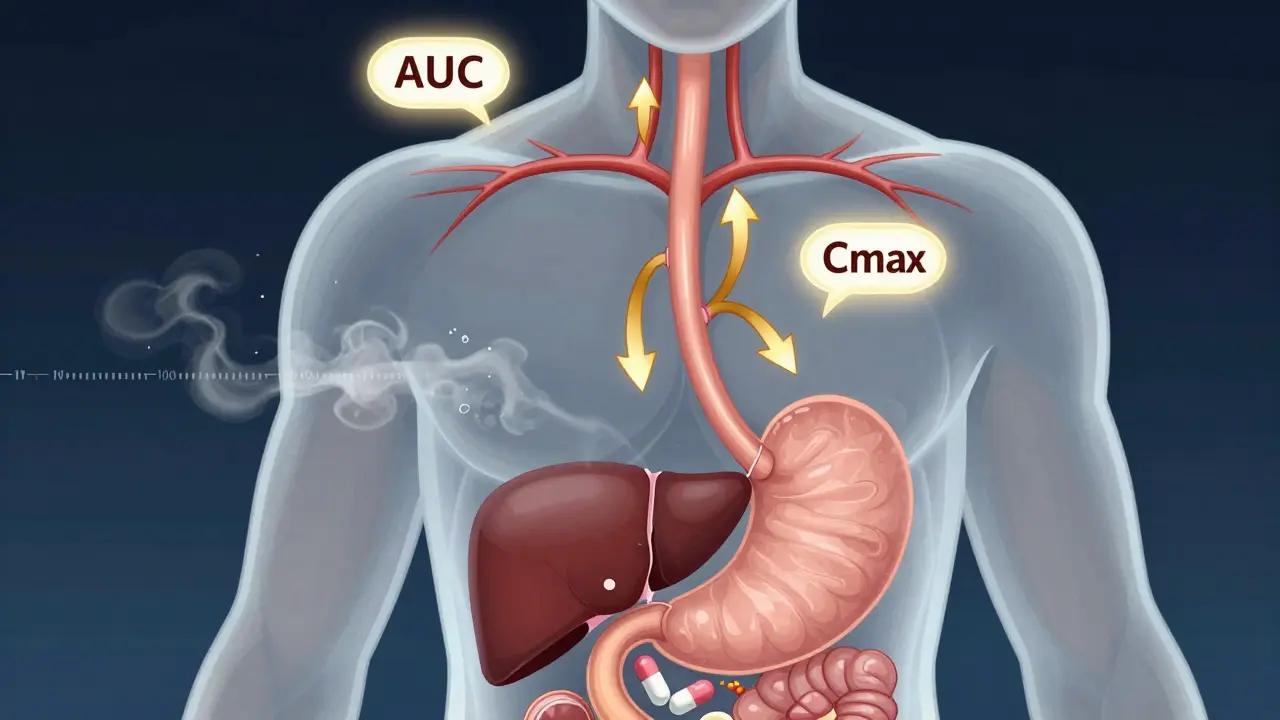
On la calcule avec deux chiffres clés : l’AUC et la Cmax. L’AUC, c’est l’aire sous la courbe - une mesure de la quantité totale de médicament qui circule dans votre sang sur plusieurs heures. La Cmax, c’est la concentration maximale atteinte. Si un médicament a une biodisponibilité de 60 %, cela signifie que 60 % de la dose ingérée finit dans votre circulation sanguine. Le reste, c’est du perdu.
Il existe deux types de biodisponibilité. La absolue, qui compare l’administration orale à une injection intraveineuse (considérée comme 100 % efficace). Et la relative, qui compare deux formes différentes du même médicament - par exemple, une pilule contre un sirop. C’est cette dernière qui sert de base à l’équivalence biologique.
Qu’est-ce que l’équivalence biologique ?
L’équivalence biologique, c’est une comparaison. Pas une mesure isolée. Elle répond à une question simple : est-ce que le générique agit comme le médicament d’origine ?
Pour le savoir, les autorités sanitaires font une étude. 24 à 36 volontaires sains prennent d’abord le médicament de référence (le brand), puis, après une période de lavage, le générique. On prélève leur sang toutes les 30 minutes pendant 72 heures. On calcule l’AUC et la Cmax pour chaque produit. Ensuite, on compare les résultats.
La règle est simple mais puissante : la différence entre les deux doit être inférieure à 20 %. Mais pas comme vous le pensez. Ce n’est pas une différence additive. C’est une différence multiplicative. Donc, on utilise une transformation logarithmique. Le résultat ? La valeur de l’AUC et de la Cmax du générique doit être comprise entre 80 % et 125 % de celle du brand. C’est ce qu’on appelle la règle 80/125.
Par exemple, si le brand atteint une Cmax de 100 ng/mL, le générique doit atteindre entre 80 et 125 ng/mL. Si c’est 79 ou 126, il n’est pas considéré comme équivalent. Ce seuil n’est pas arbitraire. Il a été choisi après des décennies d’études pour garantir que les effets thérapeutiques sont identiques, avec une marge de sécurité.
La différence entre biodisponibilité et équivalence biologique
Beaucoup confondent les deux. Voici la clé : la biodisponibilité parle d’un seul produit. L’équivalence biologique parle de deux produits en comparaison.
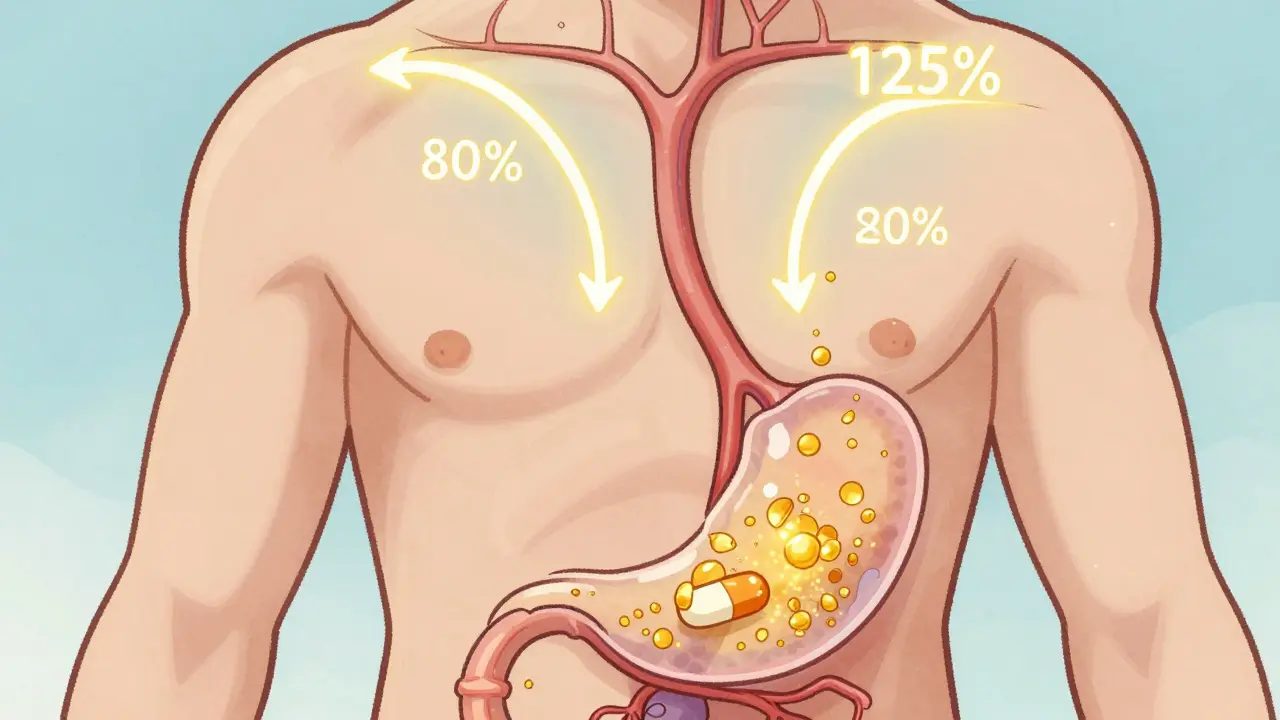
Prenez un médicament comme le paracétamol. Sa biodisponibilité est d’environ 80 % en comprimé. C’est une donnée intrinsèque. Mais si vous comparez un paracétamol de marque avec un générique, vous parlez d’équivalence biologique. Le générique peut avoir une biodisponibilité de 78 %, et le brand de 82 %. Ce n’est pas grave - tant que le rapport est entre 80 et 125 %, ils sont équivalents.
Autre point important : l’équivalence biologique ne mesure pas seulement la quantité, mais aussi la vitesse. C’est pourquoi Tmax, le temps pour atteindre la concentration maximale, est aussi mesuré. Mais ici, la règle est plus souple. Une différence de 15 minutes entre deux produits n’est pas un problème - tant que l’AUC et la Cmax sont dans la zone acceptable.
Et les médicaments à indice thérapeutique étroit ?
Il existe des médicaments où même une petite variation peut être dangereuse. C’est le cas de la warfarine (anticoagulant), de la levothyroxine (thyroïde), ou de la phénytoïne (antiépileptique). Pour eux, la règle 80/125 est trop large.
En 2023, la FDA a exigé des limites plus strictes pour ces produits. Pour la warfarine, l’AUC doit être entre 90 % et 112 % du brand. La Cmax reste à 80-125 %. C’est une adaptation fine, basée sur des décennies d’observations cliniques. Des études montrent que même des différences de 10 % peuvent entraîner des saignements ou des caillots chez certains patients.
C’est pourquoi les pharmaciens sont souvent plus prudents avec la levothyroxine. Même si les génériques sont approuvés, certains médecins préfèrent garder le même fabricant pour éviter tout risque. Ce n’est pas une critique du système - c’est une prudence médicale.
Les études sont-elles fiables ?
Les études d’équivalence biologique sont rigoureuses. Elles sont réalisées dans des laboratoires certifiés, avec des protocoles standardisés par la FDA, l’EMA et d’autres agences. Les volontaires sont en jeûne, les prélèvements sont précis, les analyses sont validées.
Entre 2010 et 2020, 99,7 % des génériques approuvés aux États-Unis ont passé le test. Seulement 3 sur 1 000 ont échoué - et souvent, c’était pour des raisons techniques, pas thérapeutiques.
Des données réelles confirment ça. En 2023, une étude menée par des pharmaciens américains a suivi 1 247 patients passés du brand au générique pour des antihypertenseurs. Seuls 17 ont signalé un problème. Parmi eux, seulement 4 ont été confirmés comme liés à une différence réelle d’absorption. Les autres ? Problèmes d’adhérence, stress, ou effet placebo.
Sur Reddit, certains patients disent que leur générique de levothyroxine ne fonctionne pas aussi bien. Mais les études scientifiques montrent que ces différences sont rares, et souvent liées à des variations dans la fabrication ou à des changements de marque, pas à l’équivalence biologique elle-même.

Comment les autorités surveillent-elles ça ?
Les agences ne se contentent pas d’approuver une étude. Elles vérifient aussi la production. Un générique doit être fabriqué selon les mêmes normes de qualité que le brand. Les sites de fabrication sont inspectés régulièrement. Les lots sont testés. Les données sont auditées.
En 2022, la FDA a approuvé 752 génériques. Tous ont dû prouver leur équivalence biologique. Et pourtant, ces génériques représentent 91 % des ordonnances remplies aux États-Unis, contre seulement 22 % du coût total des médicaments. C’est un gain énorme pour les systèmes de santé.
Les nouvelles technologies arrivent. Des modèles informatiques, comme les PBPK (pharmacocinétique basée sur la physiologie), permettent désormais de prédire l’équivalence sans toujours faire d’étude sur des humains. L’EMA teste déjà des tests de dissolution in vitro pour certains produits. C’est l’avenir : moins d’essais sur des volontaires, plus de science prédictive.
Que faire si vous sentez une différence ?
Si vous passez d’un brand à un générique et que vous avez des symptômes nouveaux - fatigue, vertiges, palpitations - ne les ignorez pas. Parlez-en à votre médecin. Ce n’est pas toujours lié à la biodisponibilité. Mais il faut le vérifier.
Les cas réels d’échec d’équivalence sont rares. Mais ils existent. Et quand ils arrivent, c’est souvent parce que le médicament est à indice thérapeutique étroit, ou parce que le patient a une sensibilité particulière. Votre médecin peut faire un dosage sanguin pour vérifier la concentration du médicament dans votre sang.
Ne changez pas de générique sans avis. Même si deux génériques sont approuvés, ils peuvent provenir de fabricants différents. Et même si les deux sont équivalents au brand, ils ne sont pas nécessairement équivalents entre eux.
Conclusion : le générique, c’est sûr - mais vérifiez quand même
Le système d’équivalence biologique est l’un des plus rigoureux au monde. Il a permis des économies massives, sans compromettre la sécurité. Des millions de personnes prennent des génériques chaque jour sans problème.
La biodisponibilité vous dit combien de médicament entre dans votre corps. L’équivalence biologique vous dit que deux médicaments le font de la même manière. Ensemble, ils garantissent que vous obtenez le même effet thérapeutique, au même coût.
Alors oui, les génériques sont fiables. Mais si vous avez un traitement sensible, gardez le même fabricant. Et si vous sentez un changement, parlez-en. Votre santé mérite cette attention.
La biodisponibilité et l’équivalence biologique, c’est la même chose ?
Non. La biodisponibilité mesure combien d’un médicament entre dans votre sang. L’équivalence biologique compare deux médicaments pour voir s’ils ont la même biodisponibilité. C’est une comparaison, pas une mesure unique.
Pourquoi les génériques sont-ils moins chers ?
Parce qu’ils n’ont pas à refaire les coûteuses études de sécurité et d’efficacité du médicament d’origine. Ils doivent seulement prouver qu’ils sont équivalents biologiquement. Cela réduit les coûts de développement de 80 à 90 %.
Est-ce que tous les génériques sont équivalents entre eux ?
Chaque générique doit être équivalent au médicament de référence, mais pas nécessairement aux autres génériques. Deux génériques différents peuvent avoir des excipients ou des taux d’absorption légèrement différents. Pour les traitements sensibles, il est préférable de rester sur le même fabricant.
Pourquoi la règle est-elle 80-125 % et pas 90-110 % ?
Parce que les réponses du corps aux médicaments suivent une logique multiplicative, pas additive. Une variation de 20 % en pourcentage relatif est statistiquement équivalente à une variation de ±20 % en valeur absolue, mais plus précise. Cette règle a été validée par des décennies de données cliniques et est acceptée mondialement.
Les médicaments en spray nasal ou en crème ont-ils une équivalence biologique ?
Pour les formes topiques (crèmes, sprays), il est souvent impossible de mesurer la biodisponibilité dans le sang. Les autorités utilisent alors d’autres méthodes : tests de dissolution, études de peau, ou modèles informatiques. Les normes sont plus complexes, mais le principe reste le même : prouver que l’effet local est identique.
Que faire si mon générique ne fonctionne pas comme le brand ?
Parlez-en à votre médecin. Il peut vérifier votre taux sanguin de médicament, ou vous recommander de revenir au brand. Ne changez pas vous-même de produit. Certains cas rares de non-équivalence existent, surtout pour les traitements à indice thérapeutique étroit. Votre médecin est le seul à pouvoir décider.

Suzanne Brouillette
décembre 25, 2025 AT 15:33C’est fou comment on se méfie des génériques alors que 99,7 % passent le test 🤯 Je prends un générique de levothyroxine depuis 3 ans et je me sens mieux qu’avant !
Élaine Bégin
décembre 25, 2025 AT 23:40Arrêtez de faire des cauchemars, les génériques sont des escroqueries masquées. Mon cousin a eu un AVC après avoir switché. C’est pas une coïncidence.
Elise Alber
décembre 25, 2025 AT 23:41La biodisponibilité relative est une variable pharmacocinétique dérivée de l’AUC et de la Cmax, sous contrainte de log-normalité, avec une fenêtre de tolérance établie par l’EMA selon la directive 2001/83/CE - et pourtant, les patients continuent à confondre avec l’efficacité clinique. C’est une lacune épidémiologique majeure.
Caroline Vignal
décembre 26, 2025 AT 09:5891 % des ordonnances en génériques ? Bravo ! On économise des milliards sans sacrifier personne. Arrêtez de croire les rumeurs sur Reddit !
Guillaume Franssen
décembre 27, 2025 AT 07:52J’ai testé 3 génériques de warfarine… y’a un qui m’a fait chier les jambes, l’autre m’a mis la pression, le troisième… rien. J’ai demandé à mon biochimiste, il m’a dit que c’était pas l’équivalence biologique, c’était les excipients. Et merde.
Jean-François Bernet
décembre 29, 2025 AT 01:25Vous croyez que les labos font des études sérieuses ? Regardez les sites de production en Inde. 40 % des génériques vendus en Europe sont fabriqués là-bas. Sans inspection. Sans transparence. Vous êtes naïfs.
Cassandra Hans
décembre 29, 2025 AT 02:56...et pourtant, les données de la FDA sont publiques... et les études sont réplicables... et les laboratoires sont audités... et vous... vous préférez croire un post de 2017 sur un forum... 🤦♀️
Jérémy Dabel
décembre 30, 2025 AT 23:53Je comprends pas pourquoi on parle de 80-125% et pas 90-110… c’est pas un peu trop large ? J’ai lu un truc sur un blog qui disait que c’était pour éviter de bloquer les petits labos… c’est vrai ?
Raissa P
décembre 31, 2025 AT 22:05La médecine moderne a oublié que le corps n’est pas une machine. Une variation de 5% dans la biodisponibilité… c’est une rupture dans l’harmonie énergétique. Vous mesurez les molécules, mais pas l’âme du traitement.
olivier nzombo
janvier 1, 2026 AT 00:0999,7 % de réussite ? 😂 Et les 0,3 % ? Ce sont les gens qui sont morts. Ou qui ont eu des crises. Mais on les oublie dans les stats, non ? 🤔
Nicolas Mayer-Rossignol
janvier 1, 2026 AT 20:30Le 80-125 % ? C’est la même logique que de dire qu’un homme de 1,70 m et un homme de 2,10 m sont "équivalents" parce que leur taille moyenne est 1,90 m. La science est devenue une farce.
Pauline Schaupp
janvier 3, 2026 AT 01:02Les données sont claires, les protocoles rigoureux, les agences indépendantes. Les exceptions existent, mais elles sont statistiquement insignifiantes. La peur irrationnelle des génériques est un obstacle majeur à l’accessibilité aux soins, et elle alimente les inégalités. Il faut éduquer, pas alimenter la désinformation.
James Richmond
janvier 4, 2026 AT 16:17les gens qui disent que ça marche pas… ils ont jamais lu la notice. ou alors ils changent de générique tous les mois. c’est pas le générique qui est nul, c’est eux.
theresa nathalie
janvier 5, 2026 AT 02:39mon docteur m’a dit de rester sur le même fabricant… j’ai fait un test de sang… et c’est vrai… les niveaux changent… même si c’est dans la norme… moi je sens la différence… donc c’est pas une illusion…